根据《中华人民共和国著作权法》及《最高人民法院关于审理涉及计算机网络著作权纠纷案件适用法律若干问题的解释》的规定,本网站声明:凡本网转载作品,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责,转载信息版权属于原媒体及作者。我们力所能及地注明初始来源和原创作者,如果您觉得侵犯了您的权益,请通知我们,我们会立即删除改正。如因作品内容、版权和其它问题需要同本网联系的,请在30日内进行。

《中国药典》2020年版编制工作已完成。4月17日国家药典委员会授权中国医药科技出版社独家承担出版发行工作,可通过中国医药科技出版社确认的正规渠道订购。
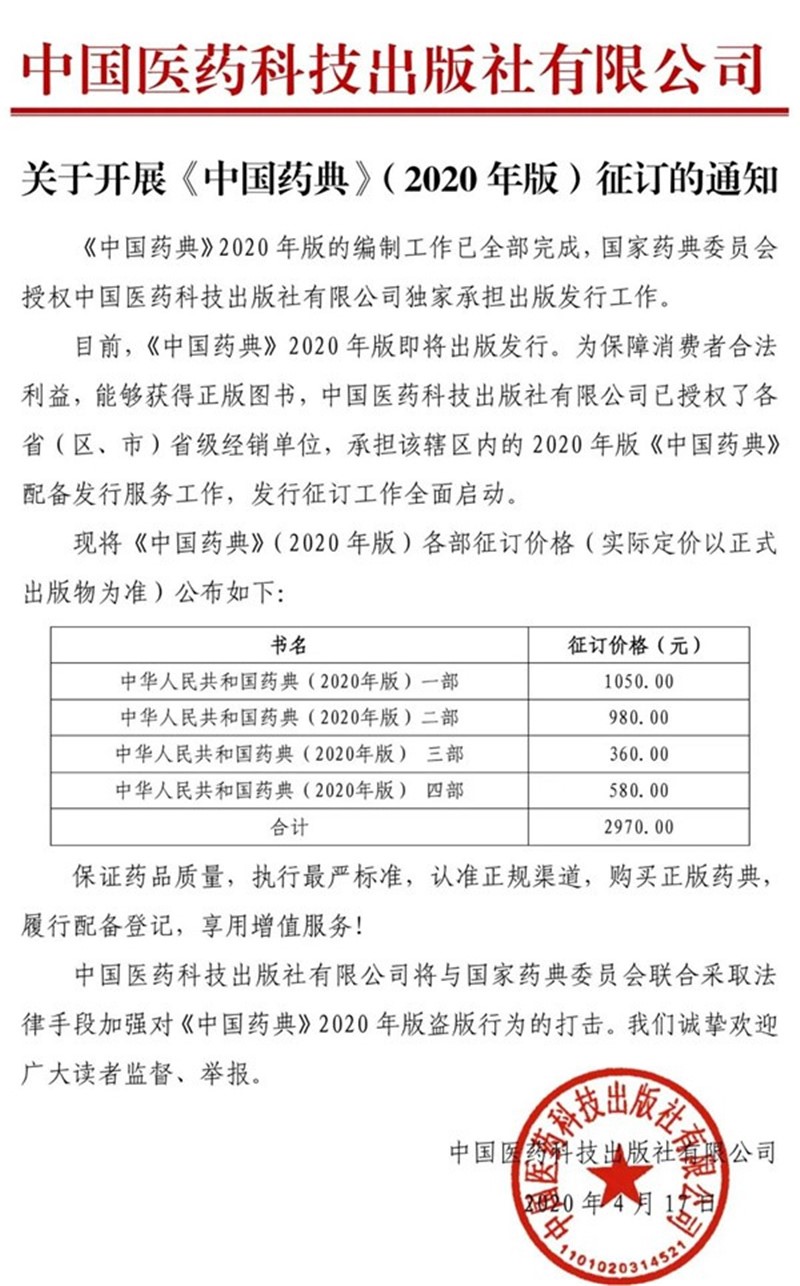
征订通知及价格:
2019整年国家药典委员会为确保标准的科学性、合理性和适用性,网站不定时公布204个中药品种(包含炮制品总共218个)的国家药品标准将修订。对其药材及饮片的性状、鉴别、检查、含量测定、浸出物、炮制等各方面做了不同的修订。我们汇总一下2020版《中国药典》有哪些新增和修订。
2020年版《中国药典》新增品种319种,修订3177种,不再收载10种,品种调整合并4种,共收载品种5911种。
一部中药收载2711种,其中新增117种、修订452种。
二部化学药收载2712种,其中新增117种、修订2387种。
三部生物制品收载153种,其中新增20种、修订126种;新增生物制品通则2个、总论4个。
四部收载通用技术要求361个,其中制剂通则38个(修订35个)、检测方法及其他通则281个(新增35个、修订51个)、指导原则42个(新增12个、修订12个);药用辅料收载335种,其中新增65种、修订212种。
中国药典一部(中药)
第一部中药,是以中医临床为导向构建中药质量控制技术体系,制定中药标准。最主要的是安全性及有效性。
安全性方面:有效控制外源性污染物对中药安全性造成的影响,全面制定中药材、饮片重金属及有害元素、农药残留的限量标准;全面制定易霉变中药材、饮片真菌毒素限量标准。有效控制内源性有毒成分对中药安全性产生的影响,重点解决符合中药特点的肝肾毒性预测及评价方法,制定中药安全用药检验标准及指导原则。
1、制定重金属及有害元素、农药残留限量标准。
1) 建立和完善重金属及有害元素、农药残留的限量标准,并将其列入相应通则项下。铅不得过5mg/kg,镉不得过1mg/kg,砷不得过2mg/kg,汞不得过0.2mg/kg,铜不得过20mg/kg ;禁用农药不得检出。
2) 修订通则2341农药残留量测定法,增订药材及饮片(植物类)中禁用农药的残留测定法。
3) 修订通则9302 中药中有害残留物限量制定指导原则。
2、制定易霉变中药材及饮片真菌毒素限量标准。(部分举例)
增订5 种真菌毒素(黄曲霉毒素、赭曲霉毒素A、玉米赤霉烯酮、呕吐毒素、展青霉素)和多种真菌毒素测定法;修订非无菌药品微生物限度标准。增订中药饮片微生物限度检查法。
1) 蜂房、土鳖虫等4 个增加了黄曲霉毒素的限量要求。
2) 薏苡仁增加玉米赤霉烯酮的限量要求。
3、有效控制内源性有毒成分对中药安全性产生的影响,重点解决符合中药特点的肝肾毒性预测及评价方法。(部分举例)
1) 九味羌活丸中肾毒性成分“马兜铃酸”的限量标准研究。
2) 补骨脂中补骨脂二氢黄酮的限量标准研究。
3) 附子中乌头碱的限量标准研究。
有效性方面:强化中药标准的专属性和整体性,不断创新和完善中药分析检验方法。重点开展基于中医临床疗效的生物评价和测定方法研究,探索建立以形态、显微、化学成分和生物效应相结合的能整体体现中药疗效的标准体系。
增修订情况
1、修订药材标准224 个(不含重金属、禁用农药涉及的数量);
2、禁用农药通用要求涉及药典收载的植物类药材标准有544 个,药材、饮片增加18个品种项下检测重金属;
3、植物油脂和提取物拟修订7 个;
4、中成药拟新增加品种117 个,修订品种160 个。

中国药典二部(化药)
有效性方面:
1、进一步完善常规固体制剂溶出及释放度检测方法。例如,铝碳酸镁咀嚼片——质酸力的研究:标准中采用溶出度第三法装置,参考BP质酸力项,10 分钟和20 分钟时,溶液的pH 应在3.0~4.2 范围内。并将质酸力滴定终点由指示剂法(溴酚蓝指示液)修订为pH 指示法(滴定至pH3.5)。克霉唑阴道膨胀栓、硝酸益康唑阴道膨胀栓增加膨胀率检查。
2、在整体质量控制方面,进一步借鉴国际要求,逐步与国际要求保持一致。例如,头孢唑肟钠参考《日本药典》(JP16)将含量限度范围由“不得少于90.0%”修订为“应为92.5%~96.5%”。
增修订情况拟新增品种共117 个,修订品种113 个。
拟不收载品种:1、转三部品种5 个(重组人胰岛素、重组人胰岛素注射液、精蛋白重组人胰岛素注射液、重组人生长激素、注射用重组人生长激素)。2、国家药监局已撤销文号停止生产的2 个品种。3、经药学遴选拟不收载的1 个品种(复方氢氧化铝片,因标准中缺少颠茄流浸膏的质量控制项)。
中国药典三部(生物制品)
安全性方面:
1、进一步完善生物制品全过程质量控制的要求。
1) 对人用狂犬病疫苗残余DNA 和HCP 限度标准进行了重新评估和修订。
2) 人和动物来源血液制品:进一步提升病毒安全性、杂质控制要求。
3) 治疗性重组蛋白制品:完善重组细胞因子类产品的杂质控制要求。
2、进一步补充完善生物检测技术、方法以及相关技术指南;推动理论分析方法在生物制品质量控制中的应用。例如,研究建立完成国际上首个PEG 修饰重组蛋白药物总论、新增基因治疗产品总论、螨变应原制品总论、人用马免疫血清制品总论。
3、完善品种收载类别,建立治疗性生物制品的相关通用技术要求;加快对我国近年来批准上市的、成熟的疫苗及治疗性生物药的收载。
1)新增涉及全球公共卫生安全问题且需求量不断增大的预防性疫苗如:脊灰疫苗(bOPV、IPV)和肺炎疫苗。
2)新增首个自主创新用于眼底黄斑病变的抗血管内皮生长因子受体抗体融合蛋白(康柏西普)。
增修订情况:新增20种、修订126种;总论:新增总论4 个,修订总论4 个。生物制品通则技术要求:新增2 个,修订8 个。通则(检测方法和指南):新增14 个,修订4 个。
中国药典四部(辅料包材、通则)
一、药包材
1、 药包材的通用技术要求拟收载4 个:
1) 药包材通则(在药包材通用要求指导原则基础上修订)。
2) 药用玻璃材料和容器通则(在药用玻璃材料和容器指导原则基础上修订)。
3) 药用塑料材料和容器通则(新增)。
4) 药用橡胶密封件通则(新增)。
2、通用检测方法拟收载18 个

二、辅料
1、 辅料的通用技术要求预计包括4 个:
通则0251 药用辅料(修订)、9601 药用辅料功能性相关指标指导原则(修订)、动物源药用辅料指导原则(新增)、预混与共处理药用辅料指导原则(新增)。
2、 拟制修订的药用辅料标准有以下特点:
1) 常用辅料、新型辅料、高风险/ 高风险制剂用辅料数量显著增加。
2) 标准描述更精准,如稀盐酸、玉米朊、活性炭。
3) 增加专属性更强的鉴别,如果胶。
4) 选用更客观的检测方法,如丁烷。
5) 增加功能性相关指标,如白陶土、硬脂酸。
6) 增加安全性指标,如玉米油。
7) 增加产品内在质量区分度,如十二烷基硫酸钠。
8) 增加特殊用途的特殊要求,如磷酸二氢钾。
9) 规范性状(溶解度、味、臭)、无菌、微生物限度、细菌内毒素等在各论中的描述。
三、 通则
修订0100 制剂通则。为了进一步引导企业全面关注制剂生产质量控制和整体要求,增加并充实了《制剂通则》的前言部分内容作为“各制剂需关注的兜底条款”,主要包括6 个方面:单位剂量均匀性、稳定性、安全性与有效性、剂型与给药途径、包装与贮藏、标签与说明书。
根据《中华人民共和国著作权法》及《最高人民法院关于审理涉及计算机网络著作权纠纷案件适用法律若干问题的解释》的规定,本网站声明:凡本网转载作品,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责,转载信息版权属于原媒体及作者。我们力所能及地注明初始来源和原创作者,如果您觉得侵犯了您的权益,请通知我们,我们会立即删除改正。如因作品内容、版权和其它问题需要同本网联系的,请在30日内进行。